Jedes s-Energieniveau kann bis zu 2 Elektronen enthalten. Jedes p-Energieniveau kann bis zu 6 Elektronen enthalten. Jedes d-Energieniveau kann bis zu 10 Elektronen aufnehmen. Jedes f-Energieniveau kann bis zu 14 Elektronen aufnehmen. 
Das d-Energieniveau hat eine etwas höhere Energie als das s-Energieniveau der unteren Elektronenschale, daher füllt sich das höhere s-Energieniveau eher als das niedrigere d-Energieniveau. Für das Schreiben einer Elektronenkonfiguration bedeutet dies, dass sie so aussieht: 1s2s2p3s3p4s3d. 
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p Zum Beispiel: Die Elektronenkonfiguration von Natrium (11 Elektronen) ist: 1s2s2p3s. 
Natrium befindet sich beispielsweise im s-Block, das letzte Orbital seiner Elektronenkonfiguration ist also s. Es befindet sich in der dritten Reihe und ersten Spalte, also ist das letzte Orbital 3s. Dies ist eine gute Möglichkeit, Ihre endgültige Antwort zu überprüfen. Für das d-Orbital ist die Regel etwas anders. Die erste Reihe von d-Block-Elementen beginnt in der vierten Reihe, aber Sie müssen 1 von der Reihennummer abziehen, da die s-Niveaus eine niedrigere Energie haben als die d-Niveaus. Zum Beispiel: Vanadium endet in 3d. Eine andere Möglichkeit, Ihre Arbeit zu überprüfen, besteht darin, alle hochgestellten Zeichen zu addieren. Sie müssen gleich der Anzahl der Elektronen im Element sein. Wenn Sie zu wenig oder zu viele Elektronen haben, müssen Sie Ihre Arbeit überdenken und es erneut versuchen. 

1: Helium 2: Neon 3: Argon 4: Krypton 5: Xenon 6: Radon Natrium befindet sich beispielsweise in der Periode 3. Wir werden Neon für die Edelgaskonfiguration verwenden, da es sich in der Periode 2 . befindet. 
Natrium hat beispielsweise 11 Elektronen und Neon hat 10 Elektronen. Die vollständige Elektronenkonfiguration für Natrium ist: 1s22p3s und Neon ist 1s22p. Wie Sie sehen, hat Natrium eine 3s, die Neon nicht hat - deshalb wird die Edelgaskonfiguration für Natrium zu [Ne]3s. Alternativ können Sie die hochgestellten Werte der Energieniveaus zählen, bis Sie zehn haben. Entferne diese Energieniveaus und geschweige denn, was übrig bleibt. Wenn Sie Neon verwenden, um die Elektronenkonfiguration für Natrium zu schreiben, bleibt ein Elektron übrig: [Ne]3s.
Schreiben der edelgaskonfiguration eines elements
Das Schreiben einer Elektronenkonfiguration für ein Element ist eine gute Möglichkeit, die Verteilung von Elektronen in einem Atom zu untersuchen. Je nach Element kann die Formel sehr lang sein. Daher haben Wissenschaftler eine Kurzschreibweise entwickelt, die ein Edelgas verwendet, um Elektronen darzustellen, die keine Valenzelektronen sind. Dies vereinfacht die Elektronenkonfiguration und erleichtert das Verständnis der chemischen Eigenschaften des Elements.
Schritte
Teil1 von 2: Die normale Elektronenkonfiguration eines Elements

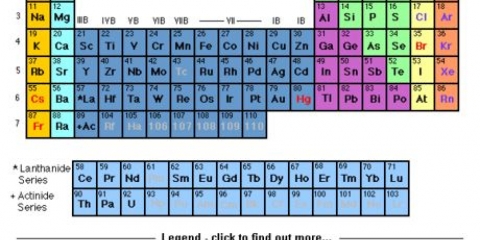
1. Bestimmen Sie die Anzahl der im Element vorhandenen Elektronen. Die Ordnungszahl eines Elements gibt an, wie viele Protonen es hat. Da Elemente in ihrem neutralen Zustand die gleiche Anzahl an Protonen und Elektronen haben, können Sie auch die Ordnungszahl als die Anzahl der Elektronen verwenden, die das Element hat. Die Ordnungszahl, die Sie in der Periodensystem, ist die Zahl direkt über dem Elementsymbol.
- Zum Beispiel: Das Symbol für Natrium ist Na. Die Ordnungszahl von Na ist 11.

2. Kenntnisse über Elektronenhüllen und Energieniveaus. Die erste Elektronenschale hat nur das s-Energieniveau, die zweite Elektronenschale hat sowohl ein s- als auch ein p-Energieniveau. Die dritte Elektronenschale hat ein s-, p- und d-Energieniveau. Die vierte Elektronenschale hat ein s-, p-, d- und f-Energieniveau. Es gibt mehr als vier Elektronenschalen, aber in der Highschool-Chemie begegnet man im Allgemeinen nur den ersten vier.

3. Lerne die Regeln der Elektronenfüllung. Nach dem Aufbau-Prinzip müssen zuerst Elektronen auf den niedrigsten Energieniveaus hinzugefügt werden, bevor ein Elektron auf einem höheren Energieniveau hinzugefügt werden kann. Jedes Energieniveau kann mehrere Suborbitale haben, aber jedes Suborbital kann zu einem bestimmten Zeitpunkt bis zu zwei Elektronen aufnehmen. Das Energieniveau s hat ein Suborbital, p hat 3 Suborbitale, d hat 5 Suborbitale und f hat 7 Suborbitale.

4. Verwenden Sie den diagonalen Konfigurationsgraphen, um Elektronenkonfigurationen zu schreiben. Der einfachste Weg, sich daran zu erinnern, wie sich Elektronen füllen, ist die Verwendung des Konfigurationsdiagramms. Darin schreibst du jede Schale und ihre Energieniveaus auf. Zeichne diagonale Linien von oben rechts nach unten links jeder Linie. Das Konfigurationsschema sieht wie folgt aus:
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p

5. Bestimmen Sie das letzte Orbital einer beliebigen Konfiguration. Durch einen Blick auf das Periodensystem können Sie die letzte Unterschale und das letzte Energieniveau der Elektronenkonfiguration bestimmen. Bestimmen Sie zuerst, in welchen Block das Element fällt (s, p, d oder f). Zählen Sie dann, in welcher Zeile sich das Element befindet. Zählen Sie zum Schluss, in welcher Spalte sich das Element befindet.
Teil 2 von 2: Die Edelgas-Elektronenkonfiguration

1. Bestimmen Sie die Edelgaselektronenkonfiguration. Die Edelgas-Elektronenkonfiguration ist eine Art verkürzte Schreibweise der vollständigen Elektronenkonfiguration eines Elements. Die Abkürzung Edelgas wird verwendet, um die Elektronenkonfiguration eines Elements zusammenzufassen und gleichzeitig die wichtigsten Informationen über die Valenzelektronen dieses Elements bereitzustellen.
- Das Edelgas wird ersetzt, um alle Elektronen darzustellen, die keine Valenzelektronen sind.
- Die Edelgase sind Helium, Neon, Argon, Krypton, Xenon und Radon und werden in der letzten Spalte des Periodensystems aufgeführt.

2. Identifizieren Sie das Edelgas in der Periode für Ihr Element. Die Periode eines Elements ist die horizontale Reihe, in der sich das Element befindet. Wenn das Element in der vierten Zeile des Periodensystems steht, befindet es sich in der vierten Periode. Das Edelgas, das Sie verwenden werden, ist in der dritten Periode. Nachfolgend finden Sie eine Liste der Edelgase und ihrer Perioden:

3. Ersetzen Sie das Edelgas durch die gleiche Anzahl von Elektronen, die das Edelgas hat. Es gibt mehrere Möglichkeiten, diesen nächsten Schritt zu tun. Sie können die Elektronenkonfiguration des Edelgases ausschreiben und dann dieselbe Konfiguration in dem Element Ihres Interesses ersetzen. Eine Alternative besteht darin, dem Element, für das Sie die Konfiguration schreiben, die gleiche Anzahl von Elektronen zu entfernen, die das Edelgas hat.
Warnungen
- Nur in einem neutralen Atom ist die Ordnungszahl gleich der Zahl der Elektronen. Ein Ion enthält eine andere Anzahl von Elektronen. Wenn das Ion eine Ladung von -1 hat, hat es ein zusätzliches Elektron. Eine Ladung -2 hat zwei zusätzliche Elektronen usw.
"Schreiben der edelgaskonfiguration eines elements"
Оцените, пожалуйста статью