Wenn es eine Dezimalzahl ist, sehen Sie sich wahrscheinlich die Atommasse an. 
Nach den Elementen 56 (Barium) und 88 (Radium) kann eine Leerstelle sein. Es gibt nicht wirklich einen Raum; die Elemente mit den dort gehörenden Ordnungszahlen stehen in zwei Reihen unter dem Rest des Systems. Der einzige Grund, warum sie so getrennt sind, ist, das Periodensystem weniger breit zu machen. 
Anders ausgedrückt: Jedes Atom mit acht Protonen ist ein Sauerstoffatom. Zwei Sauerstoffatome können eine unterschiedliche Anzahl von Neutronen oder (wenn eines ein Ion ist) eine unterschiedliche Anzahl von Elektronen haben, aber beide haben immer acht Protonen. 

In der Praxis wird die Atommasse meist schon bei chemischen Problemen angegeben, die sich nur mit einem Atom befassen. Verstehen Sie dieses Konzept, um nicht überrascht zu sein, wenn es vom Atomgewicht abweicht. 
Dies funktioniert, weil Neutronen und Protonen beide nahe 1 AMU sind und Elektronen nahe 0 AMU. Für das Atomgewicht werden genaue Messungen verwendet, um die Dezimalzahl zu erhalten, aber wir interessieren uns nur für die ganzen Zahlen, die uns die Anzahl der Protonen und Neutronen angeben. Denken Sie daran, dass Sie bei Verwendung des Atomgewichts einen Durchschnitt für eine typische Probe erhalten. Eine Bromprobe hat eine Massenzahl von etwa 80, aber wie sich herausstellt, hat ein einzelnes Bromatom fast immer eine Massenzahl von 79 oder 81. 
Ein einzelnes Heliumatom (He) hat eine Massenzahl von 4 und eine Ordnungszahl von 2. Daher muss es 4 - 2 = . sein 2 Neutronen haben. Eine Silberprobe (Ag) hat eine Massenzahl von etwa 108 (nach dem Periodensystem) und eine Ordnungszahl von 47. Im Durchschnitt hat jedes Silberatom in der Probe 108 - 47 = 61 Neutronen. 
Isotope haben keine andere Ordnungszahl. Jedes Isotop eines Elements hat die gleiche Anzahl von Protonen.
Bestimme die ordnungszahl eines elements
Die Ordnungszahl eines Elements ist die Anzahl der Protonen im Kern eines einzelnen Atoms dieses Elements. Die Ordnungszahl eines Elements oder Isotops ändert sich nicht, sodass Sie die Ordnungszahl verwenden können, um andere Eigenschaften eines Elements oder Isotops zu berechnen, beispielsweise die Anzahl der Neutronen.
Schritte
Teil 1 von 2: Die Ordnungszahl finden

1. Finden Sie eine Kopie des Periodensystems. Hier findest du einen, falls du keinen zur Hand hast. Jedes Element hat eine andere Ordnungszahl, daher gibt es keine schnellen und einfachen Methoden zur Anwendung. Sie müssen entweder eine Kopie des Periodensystems oder eine finden muss auswendig lernen.
- Die meisten Chemiebücher haben ein aufgedrucktes Periodensystem auf der Innenseite des Umschlags.

2. Finden Sie das Element, das Sie studieren. Die meisten Periodensysteme enthalten die vollständigen Namen der verschiedenen Elemente sowie ihre chemischen Symbole (wie Hg für Quecksilber). Wenn Sie das Element nicht finden können, suchen Sie online nach "chemisches Symbol", gefolgt vom Namen des Elements.

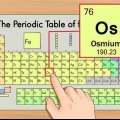
3. Finden Sie die Ordnungszahl. Die Ordnungszahl steht normalerweise in der oberen linken oder rechten Ecke der Box, in der sich das Element befindet, sie kann aber auch an einer anderen Stelle in der Box stehen. Die Ordnungszahl ist immer eine ganze Zahl.

4. Vergleichen Sie mit benachbarten Elementen. Das Periodensystem ist nach der Ordnungszahl geordnet. Wenn die Ordnungszahl Ihres Elements `33` ist, sollte das linke Element `32` und das rechte Element `34` sein. Wenn diese Reihenfolge richtig ist, hast du definitiv die Ordnungszahl gefunden.

5. Verstehe, was die Ordnungszahl ist. Es gibt eine einfache Definition für die Ordnungszahl eines Elements: die Anzahl der Protonen in einem Atom dieses Elements. Dies ist die grundlegende Definition eines Elements. Die Anzahl der Protonen bestimmt die elektrische Gesamtladung des Kerns, die bestimmt, wie viele Elektronen ein Atom haben kann. Da Elektronen für fast alle chemischen Reaktionen verantwortlich sind, bestimmt die Ordnungszahl indirekt fast alle physikalischen und chemischen Eigenschaften eines Elements.
Teil2 von 2: Verwandte Informationen finden

1. Das Atomgewicht finden. Das Atomgewicht wird normalerweise unter dem Namen des jeweiligen Elements im Periodensystem gedruckt und normalerweise auf zwei oder drei Dezimalstellen berechnet. Dies ist die durchschnittliche Masse eines Atoms des Elements, angepasst an das, was Sie wahrscheinlich in der Natur antreffen. Diese Zahl ist in "atomic mass units" (AMU (aus dem Englischen "atomic mass unit")).
- Einige Wissenschaftler verwenden den Begriff "relative Atommasse" anstelle von "Atomgewicht".

2. Verstehe was die Atommasse ist. Atommasse ist ein Konzept, das dem des Atomgewichts sehr ähnlich ist. Der einzige Unterschied besteht darin, dass Sie von einem bestimmten Atom sprechen und nicht vom Durchschnitt einer Probe. Ein Gramm Eisen enthält viele Atome mit leicht voneinander abweichenden Massen, also suche nach dem "relativen Gewicht", um den Durchschnitt zu finden. Wenn Sie nur an einem bestimmten Eisenatom interessiert sind, spielt der Durchschnitt für Sie keine Rolle – Sie interessieren sich nur für die genaue Masse dieses bestimmten Atoms.

3. Auf Massezahl runden. Die Massenzahl ist die Gesamtzahl der Protonen plus Neutronen in einem Atom eines Elements. Diese Zahl findest du ganz einfach: Nimm einfach das im Periodensystem angegebene Atomgewicht und runde auf die nächste ganze Zahl.

4. Berechnen Sie die Anzahl der Neutronen. Sie wissen jetzt, dass die Ordnungszahl = Anzahl der Protonen und die Massenzahl = Anzahl der Protonen + Anzahl der Neutronen. Um herauszufinden, wie viele Neutronen ein Element enthält, musst du die Ordnungszahl von der Massenzahl abziehen. Hier einige Beispiele:

5. Verstehe, was Isotope sind. Ein Isotop ist eine bestimmte Form eines Elements mit einer bestimmten Anzahl von Neutronen. Wenn eine Chemiefrage von "Bor-10" oder "B" spricht, spricht man von dem Element Bor mit einer Massenzahl von 10. Verwenden Sie diese Massenzahl anstelle des Wertes für `typisches` Bor.
Tipps
- Einige schwerere Elemente haben Atomgewichte in Klammern oder Klammern. Dies bedeutet, dass das Atomgewicht die genaue Masse des stabilsten Isotops ist und nicht der Durchschnitt mehrerer Isotope. (Dies hat keinen Einfluss auf die Ordnungszahl des Elements.)
"Bestimme die ordnungszahl eines elements"
Оцените, пожалуйста статью