Verwenden Sie den Begriff „eine Gruppe herunterlesen“, um von oben nach unten zu lesen. Die Nummerierung wird normalerweise über den Spalten angegeben; es kann jedoch auch unter andere Gruppen fallen, wie z. B. die Metalle. Die im Periodensystem verwendete Nummerierung unterscheidet sich stark. Sie können römisch (IA), arabisch (1A) oder die Zahlen 1 bis 18 sein. Wasserstoff kann in der Halogenfamilie und den Alkalimetallen oder in beiden vorkommen. 
Die Perioden sind normalerweise auf der linken Seite der Tabelle von 1 bis 7 nummeriert. Jede Periode ist länger als die vorherige. Dies hängt mit der Erhöhung des Energieniveaus der Atome im Periodensystem zusammen. 
Die Gruppe Metalle haben eine Farbe. Wasserstoff hat jedoch oft die gleiche Farbe und Gruppe wie die Nichtmetalle. Metalle haben Glanz, sind bei Raumtemperatur normalerweise fest, leiten Wärme und Strom und sind formbar und formbar. Nichtmetalle haben die gleiche Farbe. Dies sind die Elemente C-6 bis Rn-86, einschließlich H-1 (Wasserstoff). Sie haben keinen Glanz, leiten Wärme und Strom und sind nicht formbar. Sie bilden normalerweise bei Raumtemperatur ein Gas und können fest, gasförmig oder flüssig sein. Halbmetalle/Halbmetalle haben normalerweise eine violette oder grüne Farbe, als Kombination der anderen beiden Farben. Die Linie ist diagonal und erstreckt sich von den Elementen B-5 bis At-85. Sie haben einige Eigenschaften von Metallen und einige von Nichtmetallen. 
Die Nummerierung kann römische, arabische oder Standardzahlen sein. 





Bitte beachten Sie, dass es eine Ausnahme von dieser Regel gibt. Wenn das Atom Elektronen verliert oder aufnimmt, wird es zu einem elektrisch geladenen Ion. Wenn sich neben dem Symbol des Elements ein Pluszeichen befindet, bedeutet dies, dass es positiv geladen ist. Mit einem Minuszeichen ist es negativ geladen. Wenn es kein Plus- oder Minussymbol hat und es bei Ihrem Chemieproblem nicht um Ionen geht, dann ist die Anzahl der Protonen und Elektronen wahrscheinlich gleich. 


Zum Beispiel: Die Atommasse von Eisen beträgt 55.847, die Massenzahl ist also 56. Das Element hat 26 Protonen. 56 (Massenzahl) minus 26 (Protonen) ist 30. In einem einzigen Eisenatom befinden sich normalerweise 30 Neutronen. Wenn man die Anzahl der Neutronen in einem Atom ändert, entstehen Isotope, die schwerere oder leichtere Versionen des Atoms sind.
Das periodensystem der elemente verstehen
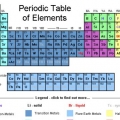
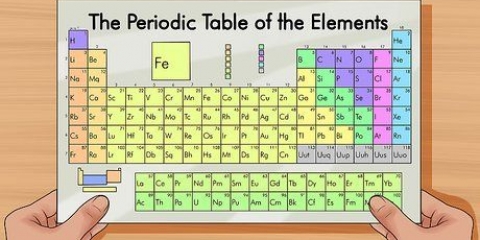
Das Periodensystem der Elemente ist eine Liste der bisher 118 entdeckten Elemente. Es gibt mehrere Symbole und Zahlen, die auf die Unterschiede der Elemente hinweisen, während die Struktur der Tabelle die Elemente nach Ähnlichkeiten organisiert. Sie können das Periodensystem anhand der folgenden Richtlinien lesen.
Schritte
Teil1 von 4: Die Struktur verstehen

1. Stellen Sie sich das Periodensystem so vor, dass es oben links beginnt und am Ende der letzten Reihe unten und rechts endet. Die Tabelle ist von links nach rechts nach aufsteigender Ordnungszahl geordnet. Die Ordnungszahl ist die Anzahl der Protonen in einem einzelnen Atom.
- Nicht jede Zeile oder Spalte ist vollständig. Auch wenn es Lücken in der Mitte geben kann, lesen Sie die Tabelle weiter von links nach rechts. Wasserstoff hat beispielsweise die Ordnungszahl 1 und befindet sich in der oberen linken Ecke. Helium hat die Ordnungszahl 2 und befindet sich in der oberen rechten Ecke.
- Die Elemente 57 bis 71 werden normalerweise als Teilmenge in der unteren rechten Ecke der Tabelle dargestellt. Dies sind die `Seltenen Erden`.

2. In jeder Spalte der Tabelle finden Sie eine `Gruppe` von Elementen. Es gibt 18 Spalten.

3. In jeder Zeile der Tabelle finden Sie die `Perioden` der Elemente. Es gibt 7 Perioden. Verwenden Sie den Ausdruck `in einem Punkt lesen`, um von links nach rechts zu lesen.

4. Verstehen Sie die zusätzlichen Gruppen zu Metall, Halbmetall und Nichtmetall. Die Farben variieren stark.

5. Wisse, dass die Elemente manchmal auch in Familien angegeben werden. Dies sind die Alkalimetalle (1A), Erdalkalimetalle (2A), Halogene (7A), Edelgase (8A) und Kohlenstoffatome (4A).
Teil 2 von 4: Das Symbol und die Benennung verstehen

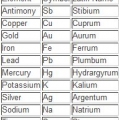
1. Lies zuerst das Symbol. Es besteht aus einem oder zwei Buchstaben und ist in mehreren Sprachen Standard.
- Das Symbol kann aus dem lateinischen Namen des Elements oder dem gebräuchlichen Namen abgeleitet werden.
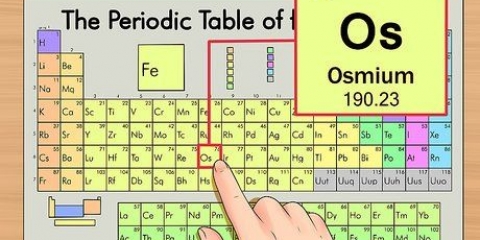
- In vielen Fällen folgt das Symbol der englischen Namenskonvention, z. B. Helium, auch bekannt als "He". Es ist jedoch keine Regel, von der Sie ausgehen können. Eisen ist zum Beispiel `Fe`. Aus diesem Grund wird die Symbol-/Namenskombination normalerweise zum schnellen Nachschlagen gespeichert.

2. Schau dir den gebräuchlichen Namen an. Dies ist direkt unter dem Symbol. Es unterscheidet sich je nach Sprache, in der das Periodensystem geschrieben ist.
Teil3 von 4: Lesen der Ordnungszahl

1. Lesen Sie das Periodensystem entsprechend der Ordnungszahl oben in der Mitte der Box jedes Elements. Wie bereits erwähnt, ist das System von links oben nach rechts unten geordnet. Die Ordnungszahl zu kennen ist der schnellste Weg, um mehr Informationen über das Element nachzuschlagen.

2. Die Ordnungszahl ist die Anzahl der Protonen im Kern eines einzelnen Atoms des Elements.

3. Durch Hinzufügen oder Entfernen von Protonen entsteht ein weiteres Element.

4. Die Bestimmung der Anzahl der Protonen in einem Atom bestimmt auch die Anzahl der Elektronen. Atome haben die gleiche Anzahl von Elektronen wie Protonen.
Teil 4 von 4: Ablesen der Atommasse

1. Bestimmen Sie die Atommasse. Dies ist die Nummer unter dem allgemeinen Namen des Elements.
- Obwohl es den Anschein hat, dass die Atommasse von links oben im System nach rechts unten zunimmt, ist dies nicht in allen Fällen der Fall.

2. Verstehen Sie, dass die meisten Elemente mit Dezimalstellen angezeigt werden. Die Atommasse ist die Summe der Teilchen im Kern; es ist jedoch ein gewichteter Durchschnitt der verschiedenen Isotope.

3. Verwenden Sie die Atommasse, um die Anzahl der Neutronen in einem einzelnen Atom zu bestimmen. Runden Sie die Atommasse auf die nächste ganze Zahl, die Massenzahl. Dann subtrahiert man die Zahl der Protonen von der Massenzahl, um die Zahl der Neutronen zu ermitteln.
"Das periodensystem der elemente verstehen"
Оцените, пожалуйста статью