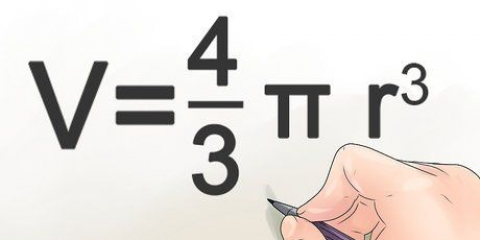Beispiel: Angenommen, wir müssen die Konzentration (in Gramm pro Liter) einer Lösung finden, die durch Auflösen von 1/2 Teelöffel Salz in 2 Litern Wasser hergestellt wird. Wir wissen auch, dass 1 Teelöffel Salz etwa 6 Gramm entspricht. In diesem Fall ist die Umrechnung einfach - multipliziere: 1/2 Teelöffel x (6 Gramm/1 Teelöffel) = 3 Gramm Salz. 3 Gramm Salz geteilt durch 2 Liter Wasser = 1.5g/l Beispiel: Angenommen, wir wollen die Molarität der obigen Salzlösung ermitteln. Um es zusammenzufassen, wir haben 3 Gramm Salz (NaCl) in 2 Liter Wasser. Beginnen Sie damit, die Molmassen von Na und Cl herauszufinden, indem Sie im Periodensystem nachsehen. Na = etwa 23 g/mol und Cl = etwa 35,5 g/mol. Also, die MM von NaCl = 23 + 35,5 = 58,5 g/mol. 3 Gramm NaCl x (1 mol NaCl/58,5 g NaCl) = 0,051 mol NaCl. 0,051 mol NaCl / 2 Liter Wasser = .026 M NaCl Was ist die Molarität von NaCL in einer 400 ml Lösung, erhalten durch Zugabe von 1.5 Gramm NaCl in Wasser? Wie hoch ist die Konzentration in ppm einer Lösung, die durch Zugabe von 0,001 g Blei (Pb) zu 150 l Wasser hergestellt wird?? (1 L Wasser = 1000 Gramm) In diesem Fall erhöht sich das Volumen der Lösung durch die Zugabe der Substanz geringfügig, sodass Sie das Volumen des Lösungsmittels als Volumen der Lösung verwenden können. Ermitteln Sie die Konzentration in Gramm pro Liter einer 0,1-Liter-Lösung, die durch Zugabe von 1/2 Mol KCl zu Wasser hergestellt wird. Dieses Problem erfordert, dass Sie von vorne nach hinten arbeiten und die Molmasse von KCL verwenden, um die Gramm KCl im gelösten Stoff zu berechnen. Stellen Sie sicher, dass alle Geräte vorgereinigt, mit entionisiertem Wasser gespült und trocken sind. Passt auf: Wenn die Reaktion zwischen der Lösung in der Bürette und dem gelösten Stoff im Kolben keine Reaktion zeigt, werden Sie Indikator muss in den Hintern stecken. Diese werden in der Chemie verwendet, um ein visuelles Signal zu geben, wenn eine Lösung den Äquivalenzpunkt oder den Endpunkt erreicht. Indikatoren werden im Allgemeinen für Titrationen verwendet, die Säure-Basen- und Redoxreaktionen untersuchen, aber es gibt auch mehrere andere Indikatoren. Konsultieren Sie ein Chemie-Lehrbuch oder das Internet, um einen geeigneten Indikator für Ihre Reaktion zu finden. Wenn die Reaktion zu einer pH- oder Potenzialänderung führt, können Sie pH-Lesegeräte oder ein Potentiometer in den Kolben stecken, um den Fortschritt der chemischen Reaktion zu messen. Für eine genauere Titration den pH-Wert oder das Potenzial wie oben angegeben überwachen und den Reaktionsverlauf jedes Mal nach Zugabe einer kleinen Menge Titriermittel notieren. Tragen Sie den Säuregehalt der Lösung oder das Potenzial gegen das Volumen des zugegebenen Titriermittels auf. Sie werden an den Äquivalenzpunkten der Reaktion scharfe Änderungen der Steigung der Kurve sehen. Nehmen Sie das Endvolumen in Ihrer Bürette auf. Indem Sie dieses vom Ausgangsvolumen in der Bürette abziehen, können Sie das genaue Volumen des verwendeten Titriermittels ermitteln. Angenommen, wir verwenden 25 ml 0,5 M NaOH, wenn wir eine Lösung von HCl in Wasser bis zum Äquivalenzpunkt titrieren. Die HCl-Lösung hatte ein Volumen von 60 ml für die Titration. Wie viele Mol HCl sind in unserer Lösung?? Schauen wir uns zunächst die chemische Reaktionsgleichung von NaOH und HCl an: NaOH + HCl > huh2O + NaCl In diesem Fall reagiert 1 Molekül NaOH mit 1 Molekül HCl zu Wasser und NaCl. Da Sie also gerade genug NaOH zugegeben haben, um das gesamte HCl zu neutralisieren, entspricht die Anzahl der bei der Reaktion verbrauchten Mole an NaOH der Anzahl der Mole an HCl im Kolben. Lassen Sie uns also herausfinden, wie viel NaOH in mol . ist. 25 ml NaOH = 0,025 l NaOH x (0,5 mol NaOH/1 l) = 0,0125 Mol NaOH. Da wir aus der Reaktionsgleichung abgeleitet haben, dass die bei der Reaktion verbrauchten Mol NaOH = die Mol HCl in der Lösung sind, wissen wir jetzt, dass es 0,0125 Mol HCl in der Lösung gibt. Um die Molarität des obigen Beispiels zu ermitteln, teilen Sie die Mole HCl durch das Volumen im Kolben. 0,0125 mol HCl x (1/0,060 l) = 0,208 M HCl. Um die Molarität in g/l, ppm oder den Prozentsatz der Zusammensetzung umzurechnen, müssen Sie die Mole Ihres gelösten Stoffes in Masse umrechnen (unter Verwendung der Molmasse Ihres gelösten Stoffes).) Für ppm und den Prozentsatz der Verbindung müssen Sie auch das Volumen Ihrer Lösung in Masse umrechnen (mit einem Umrechnungsfaktor wie Dichte oder einfach durch Wiegen) und dann das Ergebnis mit 10 bzw. 10 multiplizieren. 

Das Silbernitrat aus einer Bürette oder einer kleinen Injektionsnadel in die Aquarienprobe titrieren, bis die Lösung trüb wird. Bei einer so kleinen Stichprobe ist es wichtig, exakt Bestimmen Sie, wie viel Silbernitrat Sie hinzugefügt haben - studieren Sie jeden Tropfen sorgfältig. 
Angenommen, es sind 3 ml des 0,25 M AgNO . vorhanden3 war nötig, damit die Reaktion ablief und das Wasser nicht weiter trübte. 3 ml x 0,25 M = 0,003 L x (.25 mol AgNO3/1 Liter) = 0,000075 mol AgNO3. In diesem Fall: 1 mol AgNO3 reagiert mit 1 mol NaCl. Aber wenn 1 Mol Titriermittel mit 2 Mol unseres gelösten Stoffes reagiert, dann würden wir die Mole unseres Titriermittels mit 2 multiplizieren, um die Mole unseres gelösten Stoffes zu erhalten. Im Gegensatz dazu, wenn 2 Mol unseres Titriermittels mit 1 Mol unseres gelösten Stoffes reagieren, dann teilen wir die Anzahl der Mole des Titriermittels durch zwei. Diese Regeln entsprechen proportional 3 Mol Titriermittel und 1 Mol gelöstem Stoff, 4 Mol Titriermittel und 1 Mol gelöstem Stoff usw. sowie 1 Mol Titriermittel und 3 Mol gelöster Stoff, 1 Mol Titriermittel und 4 Mol gelöster Stoff usw. MM Na = 22.990. MM Cl = 35.453. 22.990 + 35.453 = 58,443 g/mol 0,000075 mol NaCl x 58,442 g/mol = 0,00438 mol NaCl. Passt auf: Wenn in einem Atom mehrere Moleküle einer Art vorkommen, müssen Sie die Molmasse dieses Atoms mehrmals addieren. Nimmt man zum Beispiel die Molmasse von AgNO3, Wenn Sie es finden möchten, müssen Sie die Masse oder den Sauerstoff dreimal addieren, da das Molekül drei Sauerstoffatome enthält. Der Salzgehalt von Meerwasser beträgt ca. 35 g NaCl/L. Unser Aquarium ist nicht annähernd salzig genug für Meerwasserfische.
Konzentration einer lösung bestimmen
In Chemie oder Chemie a Lösung eine homogene Mischung aus zwei Dingen -- a gelöste Substanz und ein Lösungsmittel oder Lösungsmittel in dem die Substanz gelöst ist. Konzentration ist ein Maß für die Menge an gelöstem Stoff in einem Lösungsmittel. Es kann viele Gründe geben, die Konzentration einer Lösung zu bestimmen, aber die chemische Zusammensetzung ist dieselbe, egal ob Sie den Chlorgehalt in einem Schwimmbad testen oder eine lebensrettende Analyse einer Blutprobe durchführen. In diesem Leitfaden lernen Sie einige grundlegende Teile der Chemie in Lösung kennen und führen Sie dann durch das Verfahren einer üblichen, praktischen Anwendung - der Aquarienpflege.
Schritte
Teil1 von 3: Die Grundlagen der Konzentration
1. Konzentrationsnotation. Die Konzentration eines Stoffes ist die Menge des gelösten Stoffes geteilt durch die Menge des Lösungsmittels. Da es jedoch verschiedene Möglichkeiten gibt, die Menge eines bestimmten Stoffes auszudrücken, ist es auch möglich, eine Konzentration auf verschiedene Weise auszudrücken. Hier die gängigsten Schreibweisen:
- Gramm pro Liter (g/L.) Die Masse eines gelösten Stoffes in Gramm, die in einem bestimmten Volumen einer Lösung gelöst ist (das nicht unbedingt mit dem Volumen des Lösungsmittels übereinstimmt).) Wird normalerweise für Lösungen von Feststoffen in flüssigen Lösungsmitteln verwendet.
- Molarität (M.) Die Molzahl eines gelösten Stoffes geteilt durch das Volumen der Lösung.
- Teile pro Million (ppm.) Das Verhältnis der Partikelanzahl (normalerweise in Gramm) eines gelösten Stoffes pro eine Million Teile einer Lösung multipliziert mit 10. Wird normalerweise für sehr verdünnte Lösungen in Wasser verwendet (1 L Wasser = 1000 Gramm .).)
- Prozentsatz des Verbundstoffs. Das Verhältnis der Partikel (wieder in Gramm) eines gelösten Stoffes pro 100 Partikel einer Lösung, ausgedrückt in Prozent.
2. Wissen, welche Daten Sie benötigen, um eine Konzentration zu finden. Abgesehen von der Molarität (siehe unten) erfordern die üblichen Schreibweisen einer Konzentration wie oben angegeben, dass Sie die Masse des gelösten Stoffes und die Masse oder das Volumen der resultierenden Lösung kennen. Viele chemische Probleme, bei denen die Konzentration einer Lösung gefunden werden muss, geben Ihnen diese Informationen nicht. Wenn dies der Fall ist, müssen Sie mit Ihrem Wissen arbeiten, um diese Informationen zu erhalten.
3. Erfahren Sie, wie Sie die Molarität berechnen. Die Molarität erfordert, dass Sie die Mole Ihres gelösten Stoffes kennen, aber Sie können dies leicht ableiten, wenn Sie die Masse des gelösten Stoffes und seine chemische Formel kennen. Jedes chemische Element hat ein bekanntes "Molmasse" (MM) – eine spezifische Masse für ein Mol dieses Elements. Diese Molmassen findet man im Periodensystem (meist unter dem chemischen Symbol und dem Namen des Elements).) Addieren Sie einfach die Molmassen der Komponenten des gelösten Stoffes, um die Molmasse zu berechnen. Dann multiplizieren Sie die bekannte Masse des gelösten Stoffes mit (1/MM Ihres gelösten Stoffes), um die Menge Ihres gelösten Stoffes in Mol zu ermitteln.
4. Üben Sie Standardübungen zur Berechnung von Konzentrationen. Das obige Wissen ist alles, was Sie brauchen, um die Konzentrationen in einfachen Situationen zu berechnen. Wenn Sie die Masse bzw. das Volumen der Lösung und die anfänglich zugegebene Menge an gelöstem Stoff kennen oder aus den Angaben in der Übung ableiten können, sollten Sie die Konzentration einer Lösung leicht berechnen können. Erstellen Sie Übungsübungen, um Ihre Fähigkeiten zu verbessern. Siehe die Beispielaufgaben unten:
Teil2 von 3: Titrieren
1. Verstehen, wann eine Titration anzuwenden ist. Die Titration ist eine Technik, die von Chemikern verwendet wird, um die Menge an gelöstem Stoff in einer Lösung zu berechnen. Um eine Titration durchzuführen, führen Sie eine chemische Reaktion zwischen dem gelösten Stoff und einem anderen Reagenz (normalerweise ebenfalls gelöst) durch. Da Sie die genaue Menge Ihres zweiten Reagenz und die chemische Reaktionsgleichung zwischen dem Reagenz und dem gelösten Stoff kennen, können Sie die Menge Ihres gelösten Stoffes berechnen, indem Sie messen, wie viel Reagenz Sie für die Reaktion mit dem gelösten Stoff benötigen Komplett.
- Daher können Titrationen bei der Berechnung der Konzentration einer Lösung sehr nützlich sein wenn Sie nicht wissen, wie viel gelöster Stoff im Prinzip hinzugefügt wurde.
- Wenn Sie wissen, wie viel eines gelösten Stoffes in der Lösung enthalten ist, müssen Sie nicht titrieren – messen Sie einfach das Volumen Ihrer Lösung und berechnen Sie die Konzentration, wie in Teil 1 beschrieben.
2. Richten Sie Ihr Titrationsgerät ein. Um genaue Titrationen durchzuführen, benötigen Sie saubere, genaue und professionelle Geräte. Verwenden Sie einen Erlenmeyerkolben oder ein Becherglas unter einer kalibrierten Bürette, die an einem Bürettenhalter befestigt ist. Der Ausguss der Bürette muss in den Flaschen- oder Becherhals passen, ohne die Wände zu berühren.
3. Kolben und Bürette füllen. Eine kleine Menge der unbekannten Lösung genau messen. Wenn die Substanz gelöst ist, verteilt sie sich gleichmäßig im Lösungsmittel, so dass die Konzentration dieser kleinen Probe der Lösung die gleiche wie die der ursprünglichen Lösung ist. Füllen Sie Ihre Bürette mit einer Lösung bekannter Konzentration, die mit Ihrer Lösung reagiert. Notieren Sie sich das genaue Volumen der Lösung in der Bürette – ziehen Sie das Endvolumen ab, um die gesamte in der Reaktion verwendete Lösung zu ermitteln.
4. Beginnen Sie mit der Titration. Fügen Sie nach und nach eine Lösung aus der Bürette hinzu (de "Titriermittel") in der Flasche. Verwenden Sie einen Magnetrührer oder Glasrührer, um die Lösung während der Reaktion vorsichtig zu mischen. Wenn Ihre Lösung sichtbar reagiert, sollten Sie bestimmte Anzeichen dafür sehen, dass eine Reaktion im Gange ist - Farbänderung, Blasen, Rückstände usw. Wenn Sie einen Indikator verwenden, können Sie mit jedem Tropfen, der durch die Bürette in den Kolben gelangt, eine Farbänderung sehen.
5. Verlangsamen Sie Ihre Titration. Wenn sich Ihre chemische Reaktion dem Endpunkt nähert, verlangsamen Sie die Titration, bis sie tropfenweise fortschreitet. Wenn Sie einen Indikator verwenden, stellen Sie möglicherweise fest, dass die Farbblitze länger anhalten. Titrieren Sie nun so langsam wie möglich weiter, bis Sie den genauen Tropfen bestimmen können, der dazu führt, dass Ihre Reaktion den Endpunkt erreicht. Bei einem Indikator sucht man in der Regel nach dem frühestmöglichen nachhaltigen Farbumschlag in der Reaktion.
6. Berechnen Sie die Menge an gelöstem Stoff in Ihrer Lösung. Verwenden Sie die chemische Reaktionsgleichung für die Reaktion zwischen Ihrem Titriermittel und der Lösung, um die Mole des gelösten Stoffes in Ihrem Kolben zu bestimmen. Sobald Sie die Mole des gelösten Stoffes gefunden haben, können Sie einfach durch das Volumen der Lösung im Kolben dividieren, um die Molarität der Lösung zu ermitteln, oder die Mole in Gramm umrechnen und durch das Volumen der Lösung dividieren Konzentration in g/L. Dies erfordert ein wenig Grundkenntnisse der Stöchiometrie.
7. Berechnen Sie die Konzentration Ihrer Lösung. Da Sie nun die Menge des gelösten Stoffes in Ihrer Lösung kennen, ist es einfach, die Konzentration in Bezug auf die Molarität zu bestimmen. Teilen Sie einfach die Mole des gelösten Stoffes in Ihrer Lösung durch das Volumen Ihrer Lösungsprobe (nicht das Volumen der größeren Menge, die Sie probiert haben.) Das Ergebnis ist die Molarität Ihrer Lösung!
Teil 3 von 3: Salzgehalt in einem Aquarium bestimmen

1. Nehmen Sie eine Wasserprobe aus Ihrem Aquarium. Notieren Sie die Lautstärke genau. Messen Sie das Volumen nach Möglichkeit in SI-Einheiten wie ml - diese lassen sich leicht in L . umrechnen.
- In diesem Beispiel testen wir das Wasser im Aquarium auf Salzgehalt, die Konzentration von Salz (NaCl) im Wasser. Angenommen, wir nehmen zu diesem Zweck eine Wasserprobe aus 3 ml aus dem Aquarium und setzen Sie dann die endgültige Antwort in g/l.

2. Titrieren Sie die Wasserprobe. Wählen Sie ein Titriermittel, das eine deutlich sichtbare Reaktion im gelösten Stoff hervorruft. In diesem Fall verwenden wir eine Lösung von 0,25 M AgNO3 (Silbernitrat), eine Verbindung, die bei der Reaktion mit NaCl in der folgenden Reaktion ein unlösliches Chlorsalz bildet: AgNO3 + NaCl > NaNO3 + AgCl. Das Salz (AgCl) ist als trüber, weißer Rückstand sichtbar, der aufschwimmt und von der Lösung getrennt werden kann.

3. Mach weiter bis der Kommentar aufhört. Wenn das Silbernitrat die Lösung nicht mehr trübt, können Sie die hinzugefügte Anzahl ml . notieren. Titrieren Sie das AgNO3 sehr langsam und beobachten Sie die Lösung genau, insbesondere wenn sich der Endpunkt nähert.
4. Bestimmen Sie die Molzahl des Titriermittels. Dieser Schritt ist einfach – multiplizieren Sie das Volumen des hinzugefügten Titriermittels mit der Molarität. Dadurch erhalten Sie die Molzahl des verwendeten Titriermittels.
5. Bestimmen Sie die Anzahl der Mole Ihres gelösten Stoffes. Verwenden Sie die Reaktionsgleichung zur Umrechnung der Molzahl von AgNO3 in Mol NaCl. Die Reaktionsgleichung lautet: AgNO3 + NaCl > NaNO3 + AgCl. Da 1 Mol AgNO3 mit 1 Mol NaCl reagiert, wissen wir jetzt, dass die Molzahl NaCl in unserer Lösung = die Molzahl AgNO3 das wurde hinzugefügt: 0,000075 mol.
6. Rechne die Molzahl deiner gelösten Stoffe in Gramm um. Dazu müssen Sie die Molmasse des gelösten Stoffes berechnen und mit der Anzahl der Mole Ihres gelösten Stoffes multiplizieren. Um die Molmasse von NaCl zu ermitteln, verwenden Sie das Periodensystem, um die Atomgewichte von Salz (Na) und Chlorid (Cl) zu berechnen und zu addieren.
7. Berechnen Sie die Endkonzentration. Wir haben die Masse unseres gelösten Stoffes in Gramm und wir kennen das Volumen der Testlösung. Jetzt müssen wir nur noch teilen: 0,00438 g NaCl/0,003 L = 1,46 g NaCl/l
Tipps
- Obwohl der gelöste Stoff und das Lösungsmittel in verschiedenen Zuständen (fest, flüssig oder gasförmig) vorliegen können, wenn sie getrennt werden, befindet sich die Lösung, die sich beim Auflösen der Substanz bildet, im gleichen Zustand wie das Lösungsmittel.
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
- Verwenden Sie nur durchsichtiges Plastik oder Glas.
- Hier ist ein Beispielvideo:[1]
Warnungen
- Lagern Sie die AgNO3-Lösung in einer geschlossenen, dunklen Flasche. Es ist lichtempfindlich.
- Vorsicht beim Arbeiten mit starken Säuren oder Basen. Sorgen Sie für genügend Frischluft im Raum.
- Schutzbrille und Handschuhe tragen.
- Wenn Sie das Silber zurückbekommen möchten, beachten Sie bitte Folgendes: Cu(s) + 2 AgNO3 (aq) → Cu(NO3)2 + 2 Ag (s) Denken Sie daran, dass (s) fest bedeutet.
"Konzentration einer lösung bestimmen"
Оцените, пожалуйста статью