Es ist hilfreich, alle Röhrchen zu beschriften, bevor Sie beginnen, um nicht verwirrt zu werden, wenn Sie mit der Arbeit mit den Verdünnungen beginnen. Jedes Reagenzglas enthält eine 10-fache Verdünnung im Vergleich zur unverdünnten Flüssigkeit. Das erste Reagenzglas wird 1:10 verdünnt, das zweite 1:100, das dritte 1:1000 usw. Bestimmen Sie die Anzahl der benötigten Verdünnungen im Voraus, damit Sie keine Reagenzgläser oder Verdünnungsmittel verschwenden. 
Mischen Sie die Lösung gründlich, bevor Sie sie verdünnen. 




Beispiel: Wenn Sie mit einer Zelllösung mit einer Konzentration von 1 . begonnen haben.000.000 Zellen pro ml und ein Verdünnungsverhältnis von 1.000, was ist dann die Endkonzentration der verdünnten Probe?? Verwenden der Gleichung: CEndwert=CUrsprünglicher Wert/D CEndwert=1.000.000/1.000 CEndwert=1.000 Zellen pro ml. 
Erstellen einer chemischen verdünnungsreihe
In der Chemie ist eine Verdünnung der Vorgang, bei dem die Konzentration eines Stoffes in einer Lösung verringert wird. Eine serielle Verdünnung oder Verdünnungsreihe ist die wiederholte Verdünnung einer Lösung zur schnellen Amplifikation des Verdünnungsfaktors. Dies geschieht häufig bei Experimenten, die sehr genau verdünnte Lösungen erfordern, wie beispielsweise bei Konzentrationskurven im logarithmischen Maßstab oder bei Experimenten zur Bestimmung der Keimzahldichte. Verdünnungsreihen werden häufig in experimentellen Wissenschaften wie Biochemie, Mikrobiologie, Pharmakologie und Physik verwendet.
Schritte
Methode 1 von 2: Führen Sie eine Standardverdünnung durch

1. Bestimmen Sie, was das richtige Verdünnungsmittel ist. Die Flüssigkeit, die Sie zum Verdünnen einer Substanz verwenden, ist sehr wichtig. Viele Lösungen werden in destilliertem Wasser verdünnt, dies ist jedoch nicht immer der Fall. Wenn Sie Bakterien oder andere Zellen verdünnen, werden Sie wahrscheinlich in Kulturmedien verdünnen. Die von Ihnen gewählte Flüssigkeit wird für jede serielle Verdünnung verwendet.
- Wenn Sie sich nicht sicher sind, welches Verdünnungsmittel Sie verwenden sollen, bitten Sie um Hilfe oder schauen Sie online nach, ob andere Personen eine ähnliche Verdünnung vorgenommen haben.

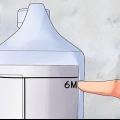
2. Bereiten Sie mehrere Reagenzgläser mit 9 ml Verdünnung vor. Diese Röhrchen dienen als Startwerte Ihrer Verdünnung. Sie werden die unverdünnte Probe in das erste Röhrchen geben und dann seriell in den folgenden Röhrchen verdünnen.

3. Bereiten Sie ein Reagenzglas mit mindestens 2 ml der unverdünnten Lösung vor. Die Mindestmenge für diese serielle Verdünnung beträgt 1 ml der unverdünnten Lösung. Wenn Sie nur 1 ml haben, erhalten Sie keine unverdünnte Restlösung. Beschriften Sie diese Tube als OO für saubere Lösung.

4. Führen Sie die erste Verdünnung durch. Nehmen Sie 1 ml der unverdünnten Lösung in ein Reagenzglas OO mit einer Pipette und überführen in das Reagenzglas mit der Aufschrift 1:10 mit 9 ml des Verdünnungsmittels und mischen. Es gibt jetzt 1 ml der unverdünnten Lösung in 9 ml des Verdünnungsmittels. Dadurch wird die Lösung um den Faktor 10 verdünnt.

5. Führen Sie die zweite Verdünnung durch. Für die zweite Verdünnungsreihe 1 ml der Lösung aus dem Reagenzglas entnehmen 1:10 und tun Sie dies mit der 9 ml-Verdünnung im Reagenzglas 1:100. Reagenzglas mischen 1:10 gründlich vor dem Einfüllen in das nächste Reagenzglas. Noch einmal das Reagenzglas 1:100 nach Verdünnung. Die Lösung des Reagenzglases 1:10 wird jetzt im Reagenzglas 10-fach verdünnt 1:100.

6. Erweitern Sie dieses Verfahren für serielle Verdünnungen mit weiteren Serien. Dieser Vorgang kann so oft wie nötig wiederholt werden, um die gewünschte Lösung zu erhalten. In einem Experiment mit Konzentrationskurven können Sie eine Reihe von Lösungen mit Verdünnungen von 1, 1:10, 1:100, 1:1000 . seriell verdünnen.
Methode 2 von 2: Berechnung des endgültigen Verdünnungsfaktors und der Konzentration

1. Berechnen Sie das Verhältnis der Endverdünnung in einer Reihenverdünnung. Das Gesamtverdünnungsverhältnis kann durch Multiplikation des Verdünnungsfaktors jedes Schrittes bis zum letzten Schritt bestimmt werden. Dies lässt sich mathematisch mit der Gleichung DT=D1 x D2 x D3 x … x Dn wodurch DT der Gesamtverdünnungsfaktor ist und Dn das Verdünnungsverhältnis.
- Nehmen wir zum Beispiel an, Sie haben eine Verdünnung von 1:10 auf eine Flüssigkeit 4x . aufgetragen. Wenden Sie Ihren Verdünnungsfaktor auf die Gleichung an: DT=10 x 10 x 10 x 10=10.000
- Der endgültige Verdünnungsfaktor im vierten Reagenzglas Ihrer Reihenverdünnung beträgt 1:10.000. Die Konzentration des Stoffes beträgt jetzt 10.000 mal weniger als die ursprüngliche unverdünnte Lösung.

2. Bestimmen Sie die Konzentration der Lösung nach der Verdünnung. Um die Endkonzentration der Lösung nach serieller Verdünnung zu bestimmen, müssen Sie die Anfangskonzentration kennen. Die Gleichung ist CEndwert=CUrsprünglicher Wert/D wodurch CEndwert ist die Endkonzentration der verdünnten Lösung, CUrsprünglicher Wert die Anfangskonzentration der ursprünglichen Lösung und D das Verdünnungsverhältnis wie zuvor bestimmt.

3. Überprüfen Sie, ob alle Einheiten übereinstimmen. Bei einer Berechnung müssen Sie darauf achten, dass die Einheiten des Endergebnisses immer korrekt sind. Wenn Sie mit „Zellen pro ml“ begonnen haben, stellen Sie sicher, dass Sie auch mit „Zellen pro ml“ enden. Wenn Ihre Anfangskonzentration in "parts per million (ppm)" angegeben ist, sollte Ihre Endkonzentration auch "ppm" sein.
"Erstellen einer chemischen verdünnungsreihe"
Оцените, пожалуйста статью