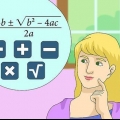Wenn die Bindungsordnung null ist, kann sich das Molekül nicht bilden. Die höheren Bindungsordnungen verleihen dem neuen Molekül mehr Stabilität. 


Je nach Größe und Komplexität eines bestimmten Atoms kann es ein bis vier Orbitale haben. Wenn die nächste Orbitalschale voll ist, sammeln sich neue Elektronen in der nächsten Orbitalschale vom Kern aus gesehen an, bis auch diese Schale voll ist. Der Elektronensatz setzt sich in immer größeren Orbitalschalen fort, denn größere Atome haben mehr Elektronen als kleinere Atome. 
Die Lewis-Struktur für zweiatomigen Stickstoff wird zu N≡N. Jedes Stickstoffatom hat ein Elektronenpaar und drei ungebundene Elektronen. Wenn sich zwei Stickstoffatome treffen, bilden die kombinierten sechs ungebundenen Elektronen eine starke kovalente Dreifachbindung. 

Bindungselektronen: Indem Sie feststellen, wie voll die Orbitalschalen jedes Atoms sind, können Sie bestimmen, wie viele der Elektronen in einem höheren Energiezustand in der Lage sind, die stabileren, niedrigeren Energieniveaus des entsprechenden Atoms zu füllen. Diese „Füllelektronen“ werden als Bindungselektronen bezeichnet. Antibindende Elektronen: Wenn zwei Atome versuchen, ein Molekül zu bilden, indem sie sich Elektronen teilen, werden einige Elektronen tatsächlich in Orbitalschalen mit höherer Energie getrieben, weil die Orbitalschalen mit niedrigerer Energie gefüllt sind. Diese Elektronen werden als antibindende Elektronen bezeichnet.
Berechnung der bindungsordnung in der chemie
Auf atomarer Ebene ist die Bindungsordnung die Anzahl der gebundenen Elektronenpaare zwischen zwei Atomen. Zweiatomiger Stickstoff (N≡N) hat zum Beispiel die Bindungsordnung 3, weil zwischen zwei Stickstoffatomen 3 chemische Bindungen bestehen. In der Molekülorbitaltheorie wird die Bindungsordnung auch als die halbe Differenz zwischen der Anzahl gebundener und ungebundener Elektronen definiert. Verwenden Sie für eine klare Antwort die folgende Formel: Bindungsordnung = [(Anzahl der Elektronen, die Molekülorbitale verbinden) - (Anzahl der Elektronen in antibindenden Molekülorbitalen)]/2.
Schritte
Methode 1 von 3: Schnell die Bindungsordnung bestimmen

1. Kenne die Formel. In der Molekülorbitaltheorie ist die Bindungsordnung definiert als die Hälfte der Differenz zwischen der Anzahl der bindenden und antibindenden Elektronen. Bindungsordnung = [(Anzahl der Elektronen, die Molekülorbitale verbinden) - (Anzahl der Elektronen in antibindenden Molekülorbitalen)]/2.

2. Wissen Sie, dass das Molekül umso stabiler ist, je höher die Bindungsordnung ist. Jedes Elektron, das einem bindenden Molekülorbital hinzugefügt wird, trägt zur Stabilisierung des neuen Moleküls bei. Jedes Elektron, das einem antibindenden Molekülorbital hinzugefügt wird, destabilisiert das neue Molekül. Schreiben Sie den neuen Energiezustand als Bindungsordnung des Moleküls auf.

3. Denken Sie an ein einfaches Beispiel. Wasserstoffatome haben ein Elektron im S-Schale und diese Schale kann zwei Elektronen enthalten. Wenn zwei Wasserstoffatome miteinander verbunden sind, füllt jedes die S-Schale des anderen. Es bilden sich zwei bindende Orbitale. Keines der Elektronen wird gezwungen, in das nächsthöhere Orbital zu wandern, das P-schälen & ndash; es werden also keine antibindenden Orbitale gebildet. Die Reihenfolge der Bindung ist also  , und das ist gleich 1. Dies bildet das Molekül H2: Wasserstoffgas.
, und das ist gleich 1. Dies bildet das Molekül H2: Wasserstoffgas.
 , und das ist gleich 1. Dies bildet das Molekül H2: Wasserstoffgas.
, und das ist gleich 1. Dies bildet das Molekül H2: Wasserstoffgas.Methode 2 von 3: Visualisierung der fundamentalen Bindungsordnung

1. Bindungsreihenfolge auf einen Blick ermitteln. Eine einfache kovalente Bindung hat eine Bindungsordnung von eins, eine kovalente Doppelbindung hat eine Bindungsordnung von zwei, eine kovalente Dreifachbindung hat eine Bindungsordnung von drei – und so weiter. In ihrer einfachsten Form ist die Bindungsordnung die Anzahl der gebundenen Elektronenpaare, die zwei Atome zusammenhalten.

2. Denken Sie darüber nach, wie Atome Moleküle zusammensetzen. Die einzelnen Atome eines Moleküls sind durch gebundene Elektronenpaare miteinander verbunden. Diese Elektronen umkreisen den Atomkern in „Orbitalen“, die jeweils nur zwei Elektronen aufnehmen können. Wenn ein Orbital nicht `vollständig gefüllt` ist -- zB., es enthält nur ein Elektron oder keine Elektronen – dann kann sich ein ungebundenes Elektron mit einem entsprechenden freien Elektron eines anderen Atoms verbinden.

3. Zeichnen Sie Lewis-Strukturen. Dies ist eine nützliche Methode, um zu visualisieren, wie die Atome in einem Molekül miteinander verbunden sind. Zeichne die Atome als ihre Buchstaben (zB. H für Wasserstoff, Cl für Chlor). Geben Sie die Bindungen als Linien an (z. B., `-` für eine Einfachbindung, `=` für eine Doppelbindung und `≡` für eine Dreifachbindung). Markiere die ungebundenen Elektronen und Elektronenpaare als Punkte (Beispiel: C:). Nachdem Sie die Lewis-Struktur gezeichnet haben, zählen Sie die Anzahl der Bindungen (die Bindungsreihenfolge).
Methode 3 von 3: Berechnen Sie die Bindungsordnung für die Orbitaltheorie

1. Verwenden Sie ein Diagramm von Elektronenorbitalschalen als Referenz. Beachten Sie, dass jede Schale immer weiter vom Atomkern entfernt ist. Entsprechend der Entropie versucht Energie immer, den niedrigsten möglichen Zustand zu erreichen. Die Elektronen versuchen immer, die niedrigsten verfügbaren Orbitalschalen zu füllen.

2. Kennen Sie den Unterschied zwischen bindenden und antibindenden Orbitalen. Wenn sich zwei Atome zu einem Molekül zusammenschließen, wollen sie die Elektronen des jeweils anderen nutzen, um die niedrigsten möglichen Zustände in den Orbitalschalen zu füllen. Bindungselektronen sind im Wesentlichen Elektronen, die zusammenkleben und in den niedrigsten Energiezustand fallen. Antibindende Elektronen sind die „freien“ oder ungebundenen Elektronen, die in höhere Orbitalniveaus geschoben werden.
"Berechnung der bindungsordnung in der chemie"
Оцените, пожалуйста статью