Beispiel: Al2Ö3. Schon2 = Aluminium; Ö3 = Sauerstoff. So wird der Name „Aluminiumoxid“. 
Beispiel: FeCl2 und FeCl3. Fe = Eisen; Cl2 = Chlorid -2;Cl3 = Chlorid -3. Die Namen wären Eisen(II)-Chlorid und Eisen(III)-Chlorid. 

Entferne ein Sauerstoffatom aus der Bindung. Die Gebühr bleibt gleich und das Ende des Anleihennamens ändert sich von „-aat“ in „–iet“. Als Beispiel: NEIN3 zu NEIN2 wechselt von „Nitrat“ zu „Nitrit.”
Ersetze das Zentralatom durch ein anderes derselben periodischen Gruppe. Als Beispiel: Sulfat SO4 kann zu Selenate SeO . werden4.

Hydroxidion: OH Nitration: NO3 Sauerstoffkarbonationen: HCO3 Permanganat-Ion: MnO4 Carbonat-Ion: CO3 Chromat-Ion: CrO4 Dichromat-Ion: Cr2Ö7 Sulfat-Ion: SO4 Sulfit-Ion: SO3 Thiosulfat-Ion: S2Ö3<2- Phosphation: PO4 Ammoniumion: NH4 Beispiel: KMnO4. Sie könnten das MnO . verwenden4 Ion muss als Permanganat erkennen. K ist Kalium, daher lautet der Name der Bindung Kaliumpermanganat.
Beispiel: NaOH. Sie sollten das OH-Ion als Hydroxid erkennen. Na ist Natrium, daher wird der Name der Bindung Natriumhydroxid sein.


1 Atom – „Mono-“ 2 Atome – „Di-“ 3 Atome – „Tri-“ 4 Atome – „Tetra-“ 5 Atome – „Penta-“ 6 Atome – „Hexa-“ 7 Atome – „Hepta-“ 8 Atome – „Okta-“ Beispiel: Aus CO wird dann Kohlenmonoxid und CO2 wird Kohlendioxid.
Beispiel: N2S3 wird dann zu Distickstofftrisulfid.
In den meisten Fällen kann die Präposition „mono-“ weggelassen werden, da sie gemeint ist, wenn sie nicht vorhanden ist. Es wird immer noch für Kohlenmonoxid verwendet, da der Begriff seit der frühen Chemie verwendet wird.
Benennen chemischer bindungen
Die Benennung der chemischen Standardbindungen ist für den Erfolg in der Chemie unerlässlich. Befolgen Sie diese Anleitung, um einige grundlegende Regeln dazu zu erfahren, wie chemische Bindungen zu ihren Namen kommen, und um zu erfahren, wie Sie chemische Bindungen benennen, mit denen Sie nicht vertraut sind.
Schritte
Methode 1 von 3: Ionenbindungen benennen

1. Verstehe, warum etwas eine Ionenbindung ist. Ionenbindungen enthalten ein Metall und ein Nichtmetall. Konsultieren Sie das Periodensystem der Elemente, um zu sehen, zu welcher Kategorie die Elemente in der Anleihe gehören.

2. Bilde den Namen. Die Benennung einer ionischen Bindung zweier Elemente ist einfach. Der erste Teil des Namens ist der Name des Metalls. Der zweite Teil ist der Name des Nichtmetalls mit dem Suffix „-ide.”

3. Übergangsmetalle erkennen. Metalle in den d- und f-Blöcken des Periodensystems werden als Übergangsmetalle bezeichnet. Ihre Ladung wird durch eine römische Ziffer angezeigt, wenn der Name der Anleihe aufgeschrieben wird. Dies liegt daran, dass sie mehr als eine Ladung haben und mehr als eine Bindung bilden können.
Methode 2 von 3: Die Benennung mehratomiger Bindungen

1. Verstehen Sie, was eine mehratomige Bindung ist. Diese Bindungen bestehen aus aneinander gebundenen Atomgruppen, wobei die gesamte Gruppe eine negative oder positive Ladung hat. Mit mehratomigen Bindungen können Sie drei Dinge tun:
- Füge am Anfang der Bindung ein Wasserstoffatom hinzu. Das Wort „Wasserstoff“ wird am Anfang des Bindungsnamens hinzugefügt. Dies reduziert die negative Ladung um eins. Als Beispiel „Karbonat“ CO3 wird zu „Hydrogencarbonat“ HCO3.




2. Merken Sie sich die gängigsten Ionengruppen. Diese bilden die Grundlage für die meisten mehratomigen Bindungen. In der Reihenfolge der größeren negativen Ladung sind dies:
3. Erstellen Sie Bindungsnamen basierend auf der Liste. Nehmen Sie jedes Element der Gruppe ion in den Namen auf. Wenn das Element vor der ionischen Gruppe steht, müssen Sie nur den Namen des Elements am Anfang des Bindungsnamens hinzufügen.


Methode 3 von 3: Die Benennung kovalenter Bindungen

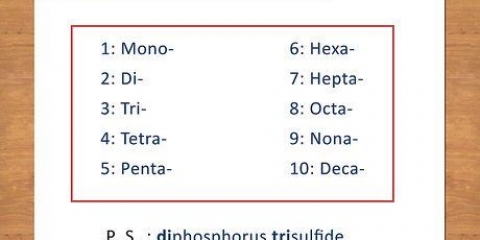
1. Verstehe was eine kovalente Bindung ist. Kovalente Bindungen werden von zwei oder mehr Nichtmetallen gebildet. Der Name der Bindung basiert auf der Menge der vorhandenen Atome. Die hinzugefügte Präposition ist der lateinische Begriff für die Menge der Moleküle.

2. Lerne die Präpositionen. Merken Sie sich die Präpositionen zu 8 Atomen:
3. Benennen Sie die Bindungen. Benennen Sie die neue Bindung mit Präpositionen. Sie fügen jedem Teil der Bindung, der mehrere Atome hat, Präpositionen an.



Tipps
- Es ist auch sehr wichtig zu verstehen, dass dies nicht für die Biochemie gilt.
- Diese Regeln sind für Leute gemacht, die gerade erst mit Chemie und Naturwissenschaften anfangen. In der fortgeschrittenen Chemie gibt es verschiedene Regeln, zum Beispiel die Regeln für die variable Valenz.
- Natürlich haben diese Regeln alle viele Ausnahmen. Zum Beispiel, obwohl CaCl2 eine 2 am Ende, es heißt immer noch Calciumchlorid und NICHT Calciumdichlorid, wie zu erwarten wäre.
"Benennen chemischer bindungen"
Оцените, пожалуйста статью