Da Atome außerordentlich klein sind, arbeiten Wissenschaftler normalerweise mit Atomen in größeren Mengen, genannt Mühle. Ein Mol ist die Menge einer Substanz mit so vielen Atomen wie in 12 Gramm des Isotops Kohlenstoff-12 . enthalten wären. Diese Zahl beträgt etwa 600 Billionen (6 mal 10 hoch 23.) Atome und ist als Avogadro-Konstante bekannt, nach dem Wissenschaftler, der sie definiert hat. 


Ein Nachschlagewerk gibt Verhältnisse an, die auf allen bekannten Isotopenmengen eines Elements basieren, während das Massenspektrometer die Verhältnisse für die getestete Probe angibt. 
Im obigen Beispiel: 12 x 0,99 = 11,88 für Kohlenstoff-12 und 13 x 0,01 = 0,13 für Kohlenstoff-13. Die relative Atommasse beträgt 11,88 + 0,13 = 12,01. (Aufgrund der Isotopenverhältnisse sind die relativen Atommassen im Periodensystem selten ganze Zahlen.)
Atommasse berechnen
Atommasse ist die Masse eines bestimmten Isotops eines bestimmten Atoms, wird aber auch missbraucht, um das durchschnittliche Gewicht einer Probe verschiedener Isotope desselben Elements zu beschreiben, das eigentlich relative Atommasse oder Atomgewicht genannt wird. Welchen Wert Sie auch immer suchen, wir zeigen Ihnen die Schritte zur Berechnung der Atommasse und der relativen Atommasse.
Schritte
Methode 1 von 2: Atommasse berechnen

1. Finden Sie die Ordnungszahl des Elements oder Isotops. Die Ordnungszahl ist die Anzahl der Protonen in einem Element, und sie ändert sich nie. Zum Beispiel: alle Wasserstoffatome, nur und nur Wasserstoffatome, haben ein Proton. Kohlenstoff hat die Ordnungszahl 6, weil sein Kern sechs Protonen hat, während Sauerstoff die Ordnungszahl 8 hat, weil sein Kern acht Protonen hat.

2. Bestimmen Sie die Anzahl der Neutronen im Kern. Die Anzahl der Neutronen kann innerhalb eines Atoms variieren – obwohl es sich um dasselbe Element handelt, gibt es verschiedene Isotope dieses Elements. Zwei Isotope desselben Elements haben die gleiche Anzahl von Protonen, aber eine unterschiedliche Anzahl von Neutronen.

3. Ignorieren Sie die Anzahl der Elektronen, die den Kern umkreisen. Die Elektronenmasse eines Atoms ist im Vergleich zu den Protonen und Neutronen im Kern vernachlässigbar.

4. Addiere die Anzahl der Protonen und Neutronen. Dies ist die Atommasse dieses Atoms.
Methode 2 von 2: Berechnen der relativen Atommasse (Atomgewicht)

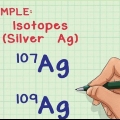
1. Bestimmen Sie die Anzahl der Isotope in der Probe. Welche Isotope sich in der Probe befinden, kann mit einem Massenspektrometer bestimmt werden.

2. Bestimmen Sie die relative Häufigkeit jedes Isotops in der Probe. Diese Informationen können durch Massenspektrometrie oder aus einem Nachschlagewerk gewonnen werden.

3. Multiplizieren Sie die Atommasse jedes Isotops mit seinem Verhältnis in der Probe. In einer Probe, die Kohlenstoff-12 und Kohlenstoff-13 enthält, multiplizieren Sie 12 mit 0,99 und 13 mit 0,01 ., wenn 99% der Probe Kohlenstoff-12 sind.

4. Addiere die Ergebnisse. Die Summe ist die relative Atommasse oder das Atomgewicht der Probe.
Tipps
- Einige Isotope sind weniger stabil als andere und zerfallen in Elemente mit weniger Protonen und Neutronen in ihren Kernen, während sie Teile von sich selbst abstoßen. Diese Isotope werden als radioaktiv bezeichnet.
Notwendigkeiten
- Massenspektrometer
- Chemisches Nachschlagewerk
- Taschenrechner
Оцените, пожалуйста статью